《铁的重要化合物》教学设计
发布时间:2018/10/18 14:16:18 作者:马明祥 浏览量:2677次
万博足球app下载官网 马明祥
《铁的重要化合物》教学设计
万博足球app下载官网 马明祥
一、教材分析
《铁的重要化合物》是在学习了《从实验学化学》(实验基础)和《化学物质及其变化》(理论基础)的基础上开始具体的元素化合物的学习,元素化合物知识是中学化学的基础和核心知识,这些知识既可以为前面的实验和理论知识补充感性认识的材料,又可以为必修2的物质结构、元素周期律等理论知识打下坚实的基础;帮助学生逐步掌握学习化学的一些基本方法;使学生正真认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用。
二、学生分析
1、学生在第一章和第三章第一节中已经学习了一定的实验基本知识和实验基本技能及实验学习的基本方法(如:有序观察、实验现象的描述、分析和解决问题的能力等),为本节学习打下了较好的基础。
2、学生在第二章已经学习了“分类思想”这一化学学科的核心思想。本章的每一节都可在分类思想的指导下进行学习,通过具体案例的学习,有利于学生进一步熟悉分类法的具体应用和深刻体会分类学习的巨大意义和价值,进而形成学科思维。
3、学生在第二章已经学习了《离子反应》和《氧化还原反应》这两类重要化学反应的有关概念和基本规律,但由于学生前面所具备的元素化合物知识很少,载体少,学生对这两大核心理论的深刻理解和灵活应用能力仍有待加强。利用第三章和第四章的元素化合物教学可不断复习和强化学生对这两大基础理论的深刻理解,这也是第三、四章教学的主要任务之一。
三、教学目标
1.知识与技能目标
(1)知识目标:掌握铁的氧化物、铁的氢氧化物的主要性质,了解其应用。掌握二价铁离子和三价铁离子的检验方法。巩固提高氧化还原反应的知识。
(2)能力目标:通过自主学习,自主进行知识网络的构建和知识的归纳整理,培养学生的自学能力和归纳总结能力。
2.过程与方法目标
(1)学会运用实验、观察等获取科学事实的基本方法,研究物质的性质。
(2)初步学会运用:分类、比较、分析、归纳、演绎等整理科学事实的基本方法,学习物质的性质。
(3)学会学习和认识新化学物质的基本思路和方法。
3.情感态度目标
(1)通过实验和观察,培养学生的科学探究精神和实事求是的科学品质。
(2)通过铁的化合物的性质与用途的学习,使学生进一步认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用,提高学习化学的兴趣,增强学好化学,服务社会的责任感和使命感。
四、重点、难点:铁的重要化合物的氧化性或还原性,二价铁离子和三价铁离子的检验方法。
五、教学过程
[引入] 今天继续学习第三章第二节的第三部分:
【板书】三、铁的重要化合物。
【提问】铁的化合物在生活中有广泛应用,初三也接触过一些,一起来回顾一些例子:
【学生回顾】:细铁丝燃烧、磁铁成分、外墙涂料、补血口服液、天然赤铁矿、磁铁矿、红砖、青砖等图片情景,列举:Fe3O4、Fe2O3、FeSO4等。
【思考】 天然赤铁矿、磁铁矿是自然界资源,涂料、补血口服液等属于我们生活中常用的用品。思考我们为什么要研究这些物质?
【学生】朗读P55页本节引言的第二句话:
【思考】这句话表达了几层含义?
【教师小结】(1)金属化合物的主要类型:金属的氧化物→氢氧化物(碱)→盐
(2)金属化合物:类别不同、价态不同,性质不同。
这是我们本节课学习的主要思路:从类别和价态角度来学习铁的三类化合物的主要性质。
【教师】请根据铁的化合价,说出铁的氧化物的化学式。
【板书】1、铁的氧化物
【教师】学生课前自学:阅读教材P59 标题1下面的内容,然后归纳整理完成下表:
表一:铁的氧化物的主要性质和用途
铁的氧化物 | 氧化亚铁 | 氧化铁 | 四氧化三铁 |
化学式 | FeO | Fe2O3 | Fe3O4 |
俗称 |
| 铁红 | 磁性氧化铁 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
水溶性 | 不溶 | 不溶 | 不溶 |
氧化物类别 | 碱性氧化物 | 碱性氧化物 | 复杂化合物 |
与盐酸的反应离子方程式 | FeO+2H+= Fe2++H2O | Fe2O3+6H+=2Fe3++3H2O | Fe3O4+8H+=Fe2++2Fe3++4H2O |
是否为碱性氧化物
| 是 | 是 | 否 |
用途 |
| 炼铁,作红色油漆和涂料 | 炼铁、磁铁 |
[过渡] 接着学习铁的氢氧化物,根据化合价写出铁的氢氧化物的化学式:
【板书】2、铁的氢氧化物
①制备Fe(OH)3 和Fe(OH)2
【实验】3-9在2支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后分别滴加NaOH溶液。观察并描述发生的现象。(3分钟)
| FeCl3溶液 | FeSO4溶液 |
滴加NaOH溶液 | 红褐色沉淀
| 生成白色絮状沉淀,迅速变成灰绿色, 最后变成红褐色 |
离子方程式 | Fe3++3OH- = Fe(OH)3↓
| Fe2++2OH- = Fe(OH)2↓ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 |
表二:铁的氢氧化物的主要性质:
名称 | 氢氧化铁Fe(OH)3 | 氢氧化亚铁Fe(OH)2 | |
物理性质 | 红褐色固体、不溶于水 | 白色固体、不溶于水 | |
化 学 性 质 | 与酸的反应 | Fe(OH)3+3H+= Fe3++ 3H2O | Fe(OH)2+2H+=Fe2++ 2H2O |
热稳定性 | 2Fe(OH)3 | 分解较复杂 | |
氧化还原角度 | 氧化性 | 还原性,极易被氧气氧化 | |
3、铁盐和亚铁盐的检验方法
(1) Fe3+的检验方法:
①观察溶液颜色:溶液为棕黄色
②加OH-:生成红褐色沉淀
③加SCN-:Fe3+ + 3SCN- === Fe(SCN)3 (红色溶液)
(2) Fe2+的检验方法:
①观察溶液颜色:溶液为浅绿色
②加OH-:生成白色沉淀迅速变灰绿色最后呈红褐色沉淀
③加SCN-后无变化,加氯水后变红。
【讨论、实验】如何证明某补铁药含二价铁离子还是三价铁离子?
【课堂小结】
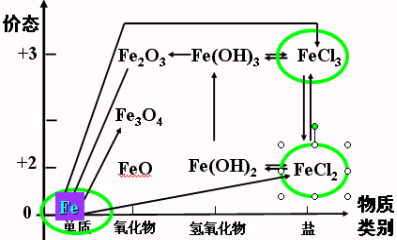
【本节作业】
课本P63 10、11
【当堂检验】
1、下列各组离子能大量共存于同一溶液的是 ( )
A. Fe3+ NH4+ Cl- H+
B. Fe2+ H+ CO32- Cl-
C. Fe3+ OH- SO42- Cl-
D. Fe2+ Ca2+ NO3- H+
2、现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是 ( )
A.苹果汁中的Fe2+变成Fe3+ B.苹果汁含有Cu2+
C.苹果汁含有OH- D.苹果汁含有Na+
3、为了检验某FeCl2溶液是否变质,可以向溶液中加入 ( )
A、 NaOH 溶液 B、 铁片 C、 KSCN 溶液 D、石蕊试液
4、证明溶液是否有Fe2+,其操作正确的顺序是 ( )
① 加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
5、在制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体。它们把该红色物质还原成黑色的化合物是 ,同时还有未烧的碳的颗粒,而制得了青色砖瓦。
1
上一篇:必修1 2016-2017学年第一学期江宁区期末试卷
下一篇:铁的重要化合物学案





